MEMSは、Microelectromechanical Systemsの略で、半導体の製作工程を利用して作られる「電気で駆動する小さな機械」を総称している。最近では、電気を使わなくても、MEMSの研究分野から発展してきた微細加工技術(MEMS技術)を利用して作られたものも広義にMEMSと呼ぶことが多い。マイクロ流体デバイスは、MEMS技術などの微細加工技術を利用して、微小流路や反応容器を作成し、バイオ研究や化学工学へ応用するためのデバイスを総称している(microTAS(micro Total Analysis Systems)やLab on a Chipなどとも呼ばれる研究分野になっている)。たとえば、入口が2つ、出口が1つのY字型の微細流路(流路幅は数百ミクロン程度)を作り、一方に赤液、他方に青液を適当な速さで流すと、交差して一本となった流路では、赤と青が混ざることなく、2層のきれいな層流になる。ここに細胞や分子などを配置しておけば、それぞれの生体試料を赤と青の2種類の薬品で局所的に刺激ができる。このように微小流体の中でのみ可能な実験などを利用して新たな生命科学が進行しつつある。 本研究室で行われている研究のほとんどが、これらの技術を基盤としている。基礎的な研究を進めるために、流路技術やマイクロ機構などの研究を独自に進めている。
流体力学的に方向制御されたナノファイバで作られたケーブル
軽量・頑丈な工業製品や、人工生体組織の材料として、ナノファイバを束ねた「ヒモ」の利用が注目されています。ナノファイバとは、ナノメートル(= 0.000000001メートル)サイズの細長い構造体です。これは細長いために縦と横で性質が異なり、ヒモの中のナノファイバの並び方がヒモ全体の特性に影響を及ぼします。しかし、非常に小さいナノファイバの向きを制御することは大変難しいことでした。我々は、マイクロ流路中でナノファイバの方向をコントロールする方法、さらにそのままヒモとして束ねる方法を見出しました。従って、同じナノファイバの原材料から、見た目は同じでも性質の異なるヒモを作製し、電気特性や丈夫さを変えることができるようになりました。実際に、同じナノファイバから作ったヒモで、電気伝導度の異方性(電気の流れやすさの方向特性)を約30倍変化させることに成功し、ナノファイバの並び方を制御することで電気の流れ方の制御が可能であることを示しました。この技術は、あらゆる繊維状材料への適用も可能で、電気電子材料の作製や生体内の複雑な紐状組織の作製への応用も期待されます。
D. Kiriya, et al.: Angewandth Chemie, 2012
小型遠心器によるマイクロゲルビーズの形成
マイクロゲルビーズは、ハイドロゲルポリマーからなる微小(直径1~1000 μm)なビーズである。蛍光物質、薬剤等の化学物質を封入することにより、センサー、創薬等幅広い分野で用いられている。また、形状、表面組成、構造を変化させることにより、様々な機能性を獲得できる。近年、生体細胞を封入することで、細胞観察、組織工学等のバイオテクノロジーへの応用が進んでいる。 現在、マイクロゲルビーズの生成は、フローフォーカシングデバイスに代表されるマイクロ流体デバイス中で、油液中のポリマーゲルの定常流を流体力学的作用によってせん断し、均一径の球体に成型し化学反応により硬化する方法が主流である。材料として、主に熱硬化性ポリマー、イオン硬化性ポリマー、光硬化性ポリマーが用いられてきた。この方法では均一径のビーズをハイスループットで生成できる。また、特に光硬化性樹脂を用いた場合、形状、内部構造を中心とするビーズの特性の調整が可能である。しかし、これらの方法は、以下の2つの要因から、マイクロ加工の領域分野外で応用することは難しかった。(1)デバイスの作製には3 次元リソグラフィーなどの特殊な装置が必要である。(2)油液とポリマーの定常流を作るために、シリンジポンプなどの精密、高価な器具を用いなければならない。また、細胞等生体活性を持つ物質の封入する際、熱硬化性ポリマー、光硬化性ポリマーは、それぞれ熱、紫外線をゲル硬化に用いるため不適切であり、アルギン酸ナトリウム等の生体適合性を持つイオン硬化性ポリマーを用いた方法でも、油液が活性を阻害する懸念があった。
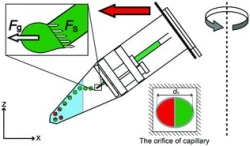
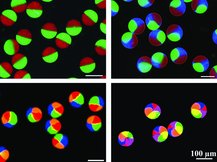
本研究では、高重力下における液体を封入された微細管からの微小液滴生成に注目、市販の素材を用い低コストでデバイス(A centrifuge-based droplet shooting device:CDSD) を開発し、卓上遠心機と組み合わせることにより、簡便なマイクロゲルビーズ作成法を考案した。材料はアルギン酸水溶液であり、塩化カルシウム溶液中でカルシウムイオンにより硬化される。この方法に、内部が2分割されたガラス管を導入し、ヤヌス構造を持つビーズ(ヤヌスビーズ)の生成に成功した。さらに、材料のアルギン酸水溶液に磁性流体、生体細胞(Jurkat)を混入することにより、片側の半球を磁化、もう片側の半球部に細胞を封入されたヘテロヤヌスビーズを生成し、外部磁場に対する応答を確認した。封入された細胞の生存率は91%に達し、本方法の高い生体適合性が示唆された。
K. Maeda, et al.: Advanced Materials, 2012, selected as the inside cover of the issue, highlighted in Nature
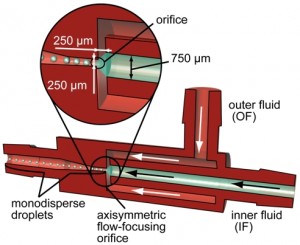
3次元マイクロ流路(AFFD: Axisymmetric Flow-Focusing Devices)
同軸の3次元マイクロ流路を光造形を利用して実現した。このデバイスは2つの入口、1つの出口流路を持っている。2本の同軸対称の中空流路の外側に油、内側に水などお互いに混じり合わない性質を持っている溶液を流す。オリフィス付近では流れが集中し、内側の流路を流れていた水溶液が均一径の液滴となる。さらに、内側と外側の溶液の流量比を変えることによって、形成される液滴の大きさを調整することができる。内側の溶液が常に外側の溶液に覆われており、形成される液滴は常に流路の中心におかれるようになるため、液滴が流路表面に接触することがない。そのため、この三次元マイクロ流路デバイスを用いることで、溶液のデバイス材料に対する親和性に関係なく液滴を均一に形成することができることが特徴である。
Y. Morimoto, et al.:Journal of Micromechanics and Microengineering, 2011
Y. Morimoto, et al.:Biomedical Microdevices, 2009
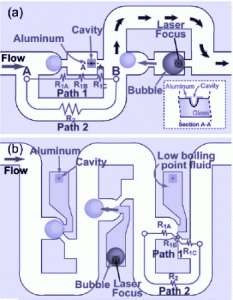
細胞ビーズを用いたダイナミックマイクロアレイ
当研究室では、従来の観察対象が固定されているマイクロアレイに対して、実験中や実験後に対象を自由に移動させることができるものとして「ダイナミックマイクロアレイ」を提案しています(PNAS 2007)。右図は、ビーズの捕捉,取出しが可能なマイクロ流体デバイスの原理。Path1よりもPath2のほうがの流路抵抗が大きいため、最初に粒子は、Path1を通るが、途中の狭窄部でトラップされる。トラップ後は、Path2の抵抗が下がり、後続の粒子はPath2を通過する。さらに、均一直径のハイドロゲルで細胞を包んだ細胞ビーズ(Advanced Materials 2007)を使ってダイナミックマイクロアレイを実現しました。細胞ビーズの取り出しには、ビーズ近辺に設置したアルミパッドに赤外線レーザを照射し暖めることでバブルを発生させ、そのバブルによってビーズを押し出します。今回、細胞に優しい取り出しプロセスを実現にするために、以下の点を工夫しました:(1)取り出すときのバブルの発生源をビーズから遠ざけた(2)バブル発生源の周囲に低融点の液体を用いた(3)発生源のアルミパッドにくぼみを設け、バブルを発生させやすくした。これらによって、細胞ビーズのアレイ化、取り出しに成功しました。細胞の網羅的解析などに利用できると考えています。
W.-H. Tan and Shoji Takeuchi: PNAS, 2007
W.-H. Tan and Shoji Takeuchi: Lab on a Chip, 2008
ハイドロゲルによる細胞の均一直径マイクロカプセル化
細胞を包む均一直径のハイドロゲルビーズを作る方法を提案しました。細胞は、同じDNAを持っていても、形や大きさは様々です。これらを一つ一つ扱うのは難しい操作になります。特に、接着細胞などは、基板に接着していないと活性を維持しないので、基板から引き剥がして位置を変更することはできません。そこで我々は、細胞をゲルで包むことを提案しました。利点は(1)形や大きさの様々な細胞でも、均一直径のビーズに包むことによって、マイクロビーズを同様の扱いをすることができる。アレイ化やソーティングなど、マイクロビーズのハンドリングのためのデバイスは多く提案されているので、これらを利用することができます。(2)細胞の周囲をゲルで包むことができるので、接着細胞にとっても活性を維持することができます。ゲルビーズを利用することで活性を維持した状態で移動できるのは、この方式のもっとも重要な特長です。作成法は、マイクロ流体デバイスでTジャンクション流路を作りそこへゲル化する溶液(アルギン酸ナトリウム+炭酸カルシウム)と細胞を混ぜて均一直径の液滴を作製します。しばらくすると液滴が有機溶媒中の物質と反応し、ゲル化します。これによって、均一直径のゲルビーズを作製することができました。
W.-H. Tan and S. Takeuchi: Advanced Materials, 2007.
パリレンを用いた超薄型フレキシブル有機ELデバイス
本研究では、薄く柔軟な有機EL発光デバイスを実現した。通常の有機ELの製作工程にパリレン(ポリパラキシリレン)薄膜の成膜プロセスを組み込むことで,これまで不可能であった,厚さ10ミクロン程度の有機EL発光デバイスを実現することができた。 近年、有機ELの実用化に向けて研究が急速に進んでいる。技術の向上により、有機ELの寿命や駆動安定性、色再現域などの性能は飛躍的に改善された。有機ELの特徴のひとつは、薄型化できることである。発光素子を利用することで、ブラウン管や液晶ディスプレイのようなバックライトを必要とせず、既存のディスプレイと比べて格段に薄いものができる。プラスチックフィルムなどの薄い基板上に構成すれば、曲げても壊れることなく発光し続ける柔軟なディスプレイが実現できる。 これまでのフレキシブル有機ELは、たとえばPETシートなどを基板として用い、厚さ約100 μmの発光デバイスが製作されてきた。この場合、デバイス厚さは95 %以上が基板であり、現状より薄くするためには、基板の薄膜化が必須であった。しかし、さらに基板を薄くすると、製作工程でのハンドリングが困難となり、新たな製作法が望まれていた。そこでここでは、基板と有機ELデバイスを最終的に分離し、厚さが基板に依存しない製作方法を提案した。物質の柔軟性はその厚さの三乗に比例するため、ここで提案する手法によって大幅に有機ELの薄膜化が実現できれば、発光デバイスを球形や凹凸の激しい3D構造に貼り付けたり、折り曲げることも可能となり、有機ELのさらなる応用範囲が広がると考えている。
T. Yamamura, et al.: MEMS 2007, pp. 739-742, 2007.
2007年 1月19日 日刊工業新聞(1面): 超薄型0.02実現 有機ELデバイス
その他の研究成果
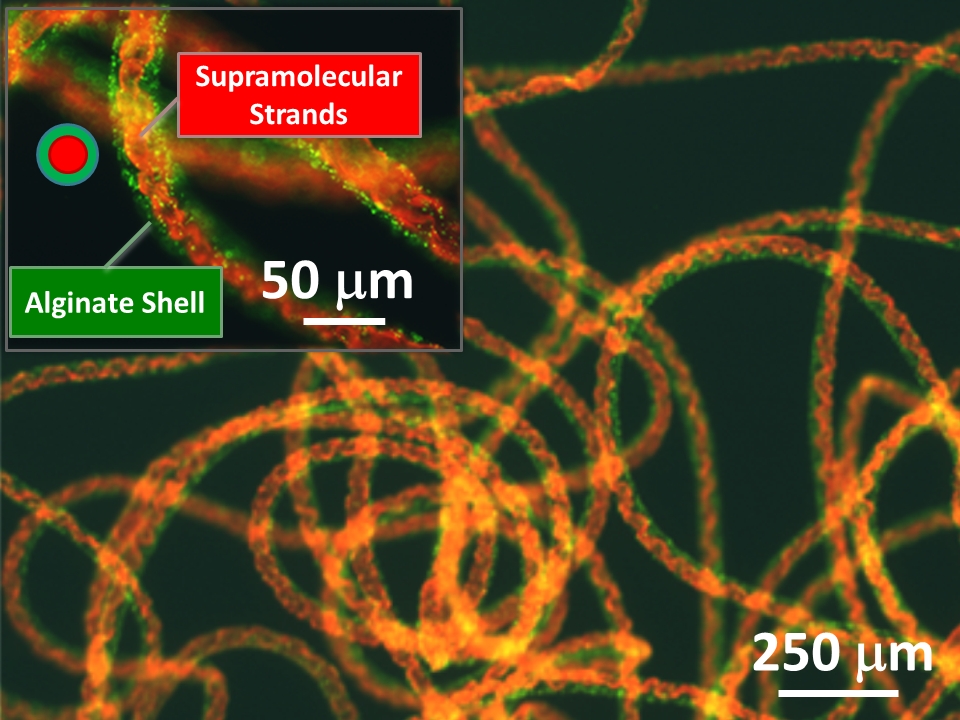
メートル級の超分子ファイバケーブル
ナノメートルスケールの分子を一つずつ組み合わせて作られる超分子材料は、親水性や疎水性・電荷など、素材に対して様々な化学特性を最適化できることがその特徴となっており、化学における一大分野となっています (ナノメートル = 0.000000001 メートル)。 本研究では、そのような超分子材料の一つである、超分子ゲルに注目しています。超分子ゲルは、分子が集まったナノファイバが互いに絡まることで、水を大量に取り込んだゲルになる材料です。これは、99%程度が水でできた構造体です。 しかし、超分子ゲルは通常のフラスコで作業をするような環境だと、ゆるくバラついた状態で絡まるのみで、素材としての強度が十分ではありません。例えば、ピンセットでつまむ、というような基本的な操作すら難しい材料でした。 マイクロ流路を用いることで、このようなバラついたつながりしか持てなかった超分子ゲル同士を、メートル級の長さまで一方向揃えてヒモとして集積化することに成功しました。さらに強度不足を補うため、別の材料で覆った二重構造(コアシェル構造)のヒモ状構造の作製に成功し、ピンセットでつまむなどの取り扱いが可能となりました。本研究は、これまで扱いの難しかった分子性材料を巨大な構造体として扱うとためのプラットホームとなると考えております。また、応用先として、細胞を培養するための足場として組織構築への利用が期待されます。
D. Kiriya, et al.: Angewandth Chemie , 2012
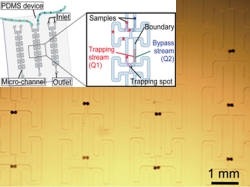
出会い系流路: 異種ビーズや細胞の隣接配置
ここでは、異なる試料間の相互作用を観察するために、これまでに提案したダイナミックマイクロアレイに、捕捉位置での隣接配置機能を付加した。限られた試料の量でも流路中で異種ビーズを隣接させた状態で容易にトラップすることができるマイクロ流路をデザインした。流路は、最初に流れ込むビーズを一つのみ捕捉する部位(トラップ流路)と、後続のビーズを詰まらせることなく下流へと送るバイパス流路から構成されている。これまでのダイナミックマイクロ流路に比べ、各流路が線対称に配置されることで、 捕捉する部位同士でビーズを合流させ、お互いに密着させることができる。実験では、マイクロサイズの試料としてポリスチレンビーズや均一直径ハイドロゲルビーズを用いて隣接配置し、ゲルビーズ間で拡散や酵素基質反応といった相互作用と細胞の隣接を確認した。これらの技術を発展させることで、将来タンパク質や細胞間の相互作用の観察や細胞融合のためのデバイスの実現が期待される。
T. Teshima, et al.: Lab on a Chip, 2010, selected in the [Emerging Investigators Issue]
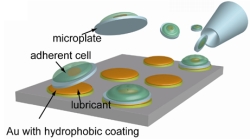
一細胞操作のためのマイクロプレート
ほとんどの細胞は接着細胞であり、どこかに接着していないと活性が低下してしまう。通常シャーレの上で培養をするが、いざそれらの細胞を一つ一つハンドリングしようと思うと、試薬を使ってシャーレから細胞を引きはがし浮遊化させなくてはいけない。この様な操作をする度に活性が低下したり、細胞サイクルが狂ったりしてしまうため、細胞を次の場所に生着させるまでに面倒な操作が必要になってくる。そこで、ここでは、マイクロ加工により製作されたマイクロプレートによる、接着細胞のハンドリング方法を提案した。この手法は、付着細胞を付着面から剥がすことなく、細胞同士の位置を変化させることが可能であるため、細胞の活性に影響を与えずハンドリングできる。プレートをフォトリソグラフィーとエッチングにより作成し、poly(dimethylsiloxane)(PDMS)シート状に配置する。この上から細胞の播くことにより、プレートの大きさに依存して1つから数個ほどの細胞がプレート上にパターニングされる。この細胞が培養されたプレートは、トリプシンやEDTAなどの酵素や化学薬品を用いることなく、ガラス管マニピュレータで機械的に力をかけることによりPDMSシートから外される。外された細胞付きマイクロプレートは、ガラス管による液流により、細胞が生きた状態のままで位置を変えることが可能である。この技術を用いて、マウス繊維芽細胞NIH/3T3と、HepG2細胞が乗ったプレートを個別に用意し、それぞれを同一ディッシュ内に自由に配置することに成功した。この技術は、細胞間の相互作用の観察や、プレートの形状を利用した細胞の自己組み立てや自己配列などへ応用可能である。
H. Onoe and S. Takeuchi: Journal of Micromechanics and Microengineering, 2008
たんぱく質の選択的パターニングのためのパリレンリフトオフプロセス
本研究では,パターンされたパリレンフィルムとPDMSマイクロチャネルを使ってたんぱく質の選択的なパターニングを実現させる手法を開発しました.たんぱく質材料を含んだ試料はマイクロチャネルによってパリレンフィルムがパターンされたパターニングスポットに運ばれます.スポットにたんぱく質が固定された後パリレンフィルムとPDMSチャネルを引き剥がすことによって,平面基板上にパターンされたたんぱく質だけが残ります.この手法によって,実際に牛血清アルブミン(BSA)を 20 μm × 20 μm のスポット、2 μm 間隔でアレイに並べたパターン上に固定することができました.また,数種類の蛍光ビーズの選択的なパターニングも実現できました.この手法は液中でも行うことができるため,たんぱく質の乾燥を防ぐことができます.さらに好ましくない場所へのたんぱく質の非特異的吸着を抑えることができるため,この手法は選択的なたんぱく質のパターニングに大変有効だと考えています.
K. Atsuta, et al: Journal of Micromechanics and Microengineering, 2007.
融合のタイミングが制御可能なエレクトロフュージョンデバイス
この研究では,電圧を加えることでドロップレット同士のフュージョンの正確なタイミング制御を可能にするエレクトロフュージョンデバイスの開発を行いました.このデバイスによって以下のことが実現可能になります.
- 化学反応や生理反応の正確な開始点の決定
- 反応物と流路壁との接触の低減(表面吸着問題の解消)
- デバイスの簡便な製作
- 反応開始点からの連続的な観察
そして,実際にこのデバイスを利用して,beta-galactosidase と fluorescein di-beta-D-galactopyranoside (FDG) の液滴をフュージョンさせ,蛍光顕微鏡で酵素反応を観察することに成功しました.更に,ピコリットルというごく少量のドロップレット同士の連続的なフュージョンにも成功しました.
W.-H. Tan and S. Takeuchi: Lab on a chip, 2006.
PDMSシートによる活性たんぱく質のマイクロパターニング
私たちは、Polydimethylsiloxane (PDMS) シートを用いて活性を保ったままでたんぱく質をガラス基盤にパターンすることに成功しました。まず、PDMSをピラミッド型のモールドにスピンコートすることによりテーパのついた孔を持つPDMSシートを作製しました。このシートを用いて、FITC (fluorescent isothiocyanate, bovine)-アルブミンを一つのスポットが5 μm x 5 μm の大きさで、アレイ状にパターンしました。パターンのスポットは完全に他と分離され、これによりたんぱく質が望んでいない場所へ非特異的に吸着してしまう問題を解決しました。また、パターニング後のたんぱく質が活性を保っていることを、活性の評価が容易なF1-ATPase 分子モーターを用いて確認しました。さらに、3種類の蛍光マイクロビーズの選択的なパターニングにも成功し、PDMSシートを用いて異なるたんぱく質を同じ基盤上にパターンすることも可能だと考えています。
K. Atsuta, et al.: Lab on a Chip, 2004
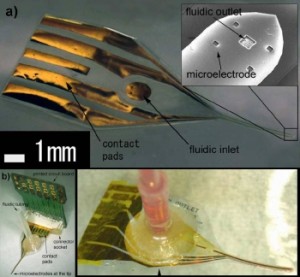
パリレンの熱圧着法によるマイクロフルイディック流路搭載型フレキシブル神経電極の製作
この研究では,神経電位計測と同時に組織内に微小容量の薬剤を注入するためのマイクロチャネルを搭載した,パリレン神経電極の作製と評価を行いました.私たちは,マイクロモールディングと加熱によるパリレン同士のボンディングによってそのような神経電極を実現しようと試みました.従来のフォトレジストの犠牲層を2層のパリレンで挟み込む方法と比較して,フォトレジスト除去の工程を省くことができることとパリレン同士の吸着性を改善することができるというのが本手法の大きな利点です.インピーダンス測定によると,この電極のインピーダンスは神経電位計測に十分なものだということが分かりました.また,流体の注入試験では実際にナノリットルの微小量を挿入することが可能となりました.
D. Ziegler, et al.: Journal of Microelectromechanical Systems, 2006
マイクロ流路の付いたパリレンフレキシブル神経電極
これまでのフレキシブル電極にマイクロチャネルを搭載することで次のような3つの機能を持たせることができます.
- 組織中に薬剤を注入する
- 神経組織からの活動電位を測る
- チャネルを固体材料で満たし電極の剛性を変化させる
この電極にはフォトリソグラフィーの手法によって高さ10ミクロンのマイクロチャネルを搭載しました.そこに,室温では固体だが水に溶解しやすいポリエチレングリコール(PEG)という材料を流し込み,これまで問題であったパリレン電極の剛性を改善することに成功しました.チャネルが生理食塩水で満たされたときの電極のインピーダンスは1 kHz で 100 kOhm 程度でした.この剛性を持たせたパリレン電極を用いることで従来の電位計測電極に比べ,より低侵襲でラット脳内の活動電位を測ることが可能になります.
S. Takeuchi, et al.: Lab on a Chip, 2005
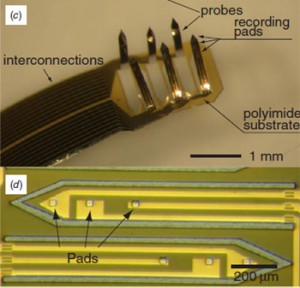
3次元フレキシブル・多チャンネル神経電極アレイ
私たちは、3次元のフレキシブル・多チャンネルマイクロ神経電極アレイのデザイン、作製・評価を行っています。それぞれの電極はいくつかの電位計測用金属パッドを持っているため、この電極アレイによって脳の中の様々な深さのところで神経活動を測定することが可能となります。またこの電極は、平面電極構造の特殊な折りたたみプロセスによって大量一括作製が可能です。このフレキシブル電極アレイをラットの脳に挿入し、低侵襲で神経電位を測定することに成功しました。
S. Takeuchi, et al.: Journal of Micromechanics and Microengineering, 2004
昆虫の自由行動時の神経電位計測のための形状記憶合金マイクロ電極付ラジオテレメトリーシステムの開発
形状記憶合金のマイクロ電極を用いてRFテレメトリー(ラジオ周波数送信)システムを製作しました.その一つのサイズは 15 mm × 8 mm で,重さは0.1 g です.このデバイスは昆虫などの背中に乗せることができるほど小さく軽いものなので,自由に動き回る昆虫の神経測定に利用することができます.このRFテレメトリーシステムは神経信号を 80-90 MHz の送信帯域に乗せることができます.変調された信号は高SN比で16メートル離れたところからまで受信することができます.実際,この送信機を昆虫の背中に乗せることで自由行動時の神経活動電位を計測することに成功しました.
S. Takeuchi, et al.: IEEE Transaction on Biomedical Engineering, 2004