培養肉・3次元組織構築
多細胞生物の組織や臓器は、異種細胞からなる複雑な三次元構造を持ち、機能的な組織や臓器を人工的に作製するには、この構造を再現することが鍵と考えられます。これまでの組織工学では、立体的な足場に細胞を蒔くこと で三次元の組織形成を行なってきましたが、この方法では軟骨などの比較的低密度の組織は形成できても、消化器官などの高密度の厚い組織や異種細胞の層構造などを再現することは困難でした。そこで、細胞ブロックを制御性良く集積することで立体組織を造形するボトムアップ型のアプローチに注目が集まっています。しかし、細胞そのものは柔らかく変形しやすいため、組み立ての高速化・精密化にはこれまで限界がありました。 そこでここでは、微細な加工・配置を得意とするMEMS技術やマイクロ流体デバイス技術と組み合わせて、細胞をあたかもネジやバネ、歯車といった規格化された部品のように加工し、厚みを持った三次元組織を機械組み立てのように 緻密かつ高速に構築することを目指します。このようなバイオテクノロジーと工学テクノロジーの融合によって実現する細胞組織構造体は、再生医療における安全な移植材料としての利用や、動物実験に依存しない薬物動態検査システ ムの構築などに役立つことが見込まれます。また、ロボットに利用するためのセンサやアクチュエータの開発など、細胞を利用したものづくりという新たな産業分野の創出につながることも期待されます。
培養ステーキ肉の形成

現在、私たちが開発に取り組んでいる三次元組織の一つに、「培養ステーキ肉」があります。私たちが普段食べている肉はウシやブタの筋肉です。この肉を、組織工学の技術を利用して人工的に作ろうという試みが「培養肉」です。具体的には、家畜から採取した少量の筋細胞を細胞培養技術で何倍にも増殖させ、それらを用いて本物の肉に似せた大きな筋組織を作ることを目指しています。通常、食肉を生産するには長い期間家畜を飼育しなければならず、広い土地や大量の水、エサとなる穀物が必要です。このような従来の生産方法は地球環境への負荷が大きいとされ、近い将来、増え続ける人口に対して食肉を充分に供給できなくなる可能性が危惧されています。「培養肉」は、細胞を培養して増殖させる段階を経ることで、元の動物から得られるよりも多くの肉を生産することができる、環境に優しい食肉生産方法と言えます。ただし、現在までにミンチ肉のような小さな組織の培養肉の構築可能性は示されていますが、ステーキ肉のような分厚い組織を作ることは困難で、大きなチャレンジです。なぜなら、血管のない組織は分厚くすると内部へ酸素や栄養を供給できず、細胞が死んでしまうからです。また、ただ筋細胞を集合させるだけでは、本物の筋肉と同じような収縮運動可能な成熟した筋組織はできません。私たちは、これまでに培ってきた三次元組織構築技術を駆使して、世界に先んじて成熟した大型筋組織(培養ステーキ肉)を構築することを目指しており、すでにサイコロステーキ状の培養肉の開発に成功しています。
培養肉の特集ページはこちらから。
細胞ビーズによる3次元細胞構造の構築
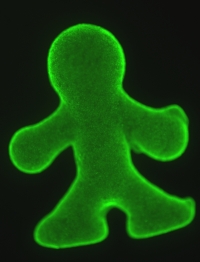
異なる種類の細胞を階層的に配置した均一直径のカプセルを作製することに成功した。また、カプセルを3次元の鋳型に入れ、培養することでカプセル同士をつなぎ、生きたまま立体構造を形成することに成功した。デモとして、直径約100ミクロンのカプセルを約10万個用いて、身長5ミリメートルの人型の組織を形成した。この技術によって、生体に近い組織形成ができるようになり、今後の薬物動態検査や再生医療への応用が期待される。 生体内の組織は、様々な種類の細胞が階層的に配置されることによって、代謝機能を発現している。そのような構造を人工的に構築することができれば、動物実験を行なわなくても薬物に対する反応などを正確に調べることができるため、創薬分野おいては重要な技術課題となっている。また、将来の再生医療は、iPS細胞のような万能細胞を一細胞レベルで分化誘導し、組織を組み上げていくことを目標としているが、この際にマイクロスケールで階層化された組織構築技術は必要不可欠である。 通常、異種の細胞は、混在させた状態で培養させても、同種の細胞同士で塊を作ってしまい、均質に一体化した組織を形成することは難しい。特殊な化学物質で細胞膜表面を修飾し、それらの化学結合を利用して異種細胞同士を密着させおくことで一体化はできるが、あらかじめ細胞を化学処理する必要があり手間がかかる。そこで、本グループは、通常細胞間に存在し、密着に深く関わっているコラーゲンを用いて異種細胞を一体化する方法を考案した。 ここでは、まずグループが開発した微小流路(Axisymmetric Flow Focusing Device(AFFD))を用いることで、直径約100ミクロンのコラーゲンからなるマイクロビーズを作製した。ビーズ内部に細胞(細胞A)を生きたまま内包することにも成功した。さらに、これらの細胞カプセルに、内包した細胞とは異なる細胞(細胞B)を培養することで、細胞Bをカプセル外周に接着させた。その後、培養を続けることで細胞Bが中心付近へ移動・増殖することで細胞Aと接着することがわかった。その結果、内側に細胞A、外側に細胞Bと階層化されたカプセルが構築できることがわかった。実験では、肝臓由来の培養細胞を内側、線維芽細胞を外側に配置したカプセルを作製した。これらの組織は、肝臓細胞だけで培養した場合に比べ、アルブミンの分泌能力が高まることが確認できた。 さらに、細胞カプセルを人型(身長5 mm, 厚さ1.25 mm)の容器内に導入し、培養を続けることでカプセル表面の細胞同士が接着し、一体化することがわかった。約24時間後に、容器から取り出しても細胞が生きている状態で一体化は維持されていた。通常、ミリメートル以上の容器になると、細胞を導入しただけでは、内部まで養分が行き届かず、死滅してしまう可能性が高くなる。本方法では、カプセルに養分が蓄えられていること、ビーズ同士の隙間から養分が内部まで浸透することなどから、これまで難しかった立体構造が形成できるようになったと考えられる。
Y. T. Matsunaga*, Y. Morimoto*, et al. (*equal contribution): Advanced Materials, 2011
細胞ファイバー

臓器や組織の置換を目指した再生医療研究では、人工的な3次元細胞組織を構築する技術の開発が求められています。これまでに、皮膚や軟骨、心筋、網膜など構造が比較的単純な細胞組織は人工的に作られ、一部は移植医療の現場で使われてきましたが、肝臓や膵臓のように多様な細胞が複雑な構造を形成している臓器を人工的に構築することは難しく、再生医療の実現に向けた究極的な目標の1つとなっています。このような臓器では、血管や神経を含む様々な種類の細胞が、数10〜数100マイクロメートルのオーダーで3次元的に微細配置されたセンチメートルサイズの構造を形成しており、体液の循環を利用して必要な生体分子の分泌やろ過などの複雑な機能を発揮しています。 このような機能を果たす人工組織を構築するためには、細胞を生きた状態のまま数10〜数100マイクロメートルの精度で配置して、センチメートルサイズの大きさまで集積することが必要ですが、今の段階ではそのような技術は存在しないのが現状です。我々の研究グループでは、様々な種類の細胞を直径およそ100マイクロメートル、長さ数メートルのファイバー状の組織に成形する方法と、そのファイバー形状の細胞組織をあたかも「ひも」のように扱い、3次元的に織ったり巻いたり束ねたりして組み上げることで、細胞の機能を維持した状態でセンチメートルサイズの3次元的な細胞組織を構築する方法を開発しました。また実際に、膵島細胞のファイバーを糖尿病疾患モデルマウスに移植することで、マウスの血糖値を正常化させることに成功し、ファイバー状の細胞組織は体内でも機能を発揮し、実際の移植にも応用できる可能性を示しました。 生体内には特に血管や神経、筋肉など繊維状の組織が多く含まれるので、今回の成果は様々な組織の構造を人工的に構築するための基盤技術として幅広い応用が期待できます。さらに、ES細胞注1)やiPS細胞注2)、MSC細胞注3)などに代表される多分化能を持つ幹細胞も、ファイバー状にしてから移植することで生着率が高まることが期待でき、糖尿病や神経損傷などの治療をはじめとした医療応用に幅広い貢献ができると考えられます。
H. Onoe, et al.: Nature Materials, 2013
細胞折り紙
細胞を立体的に培養し、3 次元的な組織を人工的に構築する技術が、基礎研究のみならず、新薬の開発や次世代再生医療などの分野で重要とされている。グループでは、MEMSを利用した微細加工技術を用いてマイクロプレートを作製し細胞を培養し、「折り紙のように折り畳む」という方法を用いて、高速に立体構造を構築する方法を確立した。 折り紙の折り畳み技術は、宇宙で展開する太陽パネルや小さく折り畳まれ血管内で展開することができるステントなどの医療器具に応用され、「折紙工学」分野として、国内外で盛んに研究が行われている。折り方の組み合わせ次第で、平面の状態から自在に複雑な構造物を作ることできるのが特長とされている。本研究では、細胞組織の立体構造構築に本手法を利用した。 まず、細胞サイズのプレートを微細加工技術によって平面上に複数個配置し、その上に細胞を培養した。隣り合ったプレートにまたがって細胞が増殖すると、細胞内部の牽引力(細胞が中心方向に縮まろうとする力)によって、2 つのプレートの一方が引き寄せられのように立ち上がることが分かった。ここでは、この原理を利用して、立方体や正十二面体、管構造などの多面体の展開図にあたるパターンをマイクロプレートで作製し、細胞培養後にそれらの牽引力によって望み通りの多面体構造をした細胞組織をつくることに成功した。また、心筋細胞などを利用すれば、自律的に駆動する多構造も作製できることを示した。 本方法により、細胞に3 次元的な変形力がかかったときに、細胞内部でどのような状態変化が起きるかなどを一細胞レベルで観察することができるほか、管や袋構造など、中空の細胞組織を高速に作る方法に応用が可能であり、新薬の開発や次世代の再生医療分野、細胞をつかった医療器具への応用が期待できる。これらの成果は、読売、毎日、日経新聞、Newton誌のほか、NewScientistやThomson Reutersなどの海外メディアにも取り上げられた。
K. Kuribayashi-Shigetomi, et al.: PLoS ONE, 2012.
階層化された三次元組織構造のプリンティング
細胞を自動的に配置するロボットを用いて、異種の細胞が階層的に配置された直方体やチューブ、リングなど様々な立体構造を高速に作製することに成功した。 上記で考案した、ビーズ状に加工した細胞組織を鋳型に流し込み任意の立体構造を作製する技術を、電子機材作製時に使う接着剤を自動で塗布するロボット(ディスペンサーロボット)と組み合わせた。 これを利用して、血管細胞や肝細胞、皮膚細胞などさまざまな種類の細胞を3次元的に組み合わせた階層構造を高速で再現性良く作製することに成功した。 この技術によって、生体のように様々な種類の細胞が階層的に配置されいる複雑な組織を立体形成できる可能性がでてきた。また将来、動物実験を行なわなくても薬物に対する反応などを正確に調べることができる技術や、iPS細胞などの万能細胞を分化誘導後に立体構築することが必要な再生医療技術などへの応用が大いに期待できる。
Y. T. Matsunaga*, Y. Morimoto*, et al. (*equal contribution): Advanced Materials, 2011

